北京时间9月4日,作为合作方之一,北京化工大学宋继彬教授团队与新加坡南洋理工大学(NTU)浦侃裔教授和山西省人民医院张瑞平教授团队,在国际顶级期刊Nature Materials上发表了题为“Molecular radio afterglow probes for cancer radiodynamic theranostics”的最新研究成果。该成果报告了有机发光体(IDPAs)在X射线照射后产生近红外余辉和1O2的情况,并将其用于癌症治疗。与已报道的无机纳米磷相比,IDPA的体内放射余辉亮度大于25倍,而1O2的放射动力学产生量大于5.7倍。IDPAs的模块化结构允许开发一种智能分子探针,只有在癌症生物标记物存在的情况下才能触发其射电余辉动态功能。因此,该探针能以极高的对比度对微小肿瘤进行超灵敏检测,并能以低剂量的分子精度对脑肿瘤进行肿瘤特异性放疗。此工作揭示了有机放射余辉制剂的分子指南,并凸显了癌症放射治疗学的新机遇。

![]()

1. 研究背景
光学成像剂已广泛应用于生物学和医学领域,是诊断和光疗提供分子特异性的重要方式之一。然而,光与组织之间的相互作用限制了光学成像剂在表层或内窥镜可触及组织中的成像和治疗能力。因此,能在光照射停止后储存光能并释放光子的余辉剂应运而生,以缓解这一问题。由于消除了组织自发荧光,此类光余辉剂可以高灵敏度地检测深层组织中的生物标记物。与激光相比,X射线具有更深的组织穿透性,允许将高能量光子传递到人体深层病灶部位,用于诊断成像和癌症放疗。然而,此类放射性余辉成像(Radio Afterglow Imaging,RAI)剂鲜有报道,仅限于少数稀土掺杂的无机纳米荧光粉。而且,通常用于余晖激发治疗的无机纳米磷光体的放射余辉动态功能始终处于开启状态,从而限制了检测的特异性和治疗效果。
2. 研究成果
(1)有机发光体的合成及余辉机理
基于受体-苯氧基-金刚烷烯骨架的合成方法成功制备了射电余辉动态发光体。首先,合成了不同的受体。然后,将这些受体分别与带有或不带有重原子(碘)的苯氧基-金刚烷连接,得到相应的含碘对应物(图 1a)。所有化合物均通过核磁共振和液相色谱-质谱法进行了确认。实验结果表明,DPAs和IDPAs的放射余辉机制与放射动力学过程密切相关(图 1b)。首先,X射线辐照DPA或IDPA会导致1O2的辐射动力学生成。然后,原位生成的1O2通过环加成反应与DPA或IDPA反应,并转化为二氧杂环丁烷中间体。最后,该中间体逐渐分解成相应的活化产物(活化的DPA或IDPA)并释放出光子。虽然两种发光体在X射线照射下都会产生1O2,但IDPA中重碘的存在不仅能增强其对X射线的吸收,还能有效地填充三重激子。因此,与不含碘的对应物相比,IDPAs在辐射动力学上产生了更多的1O2,这促进了二氧杂环丁烷中间体的形成,从而发射出更强的辐射余辉。
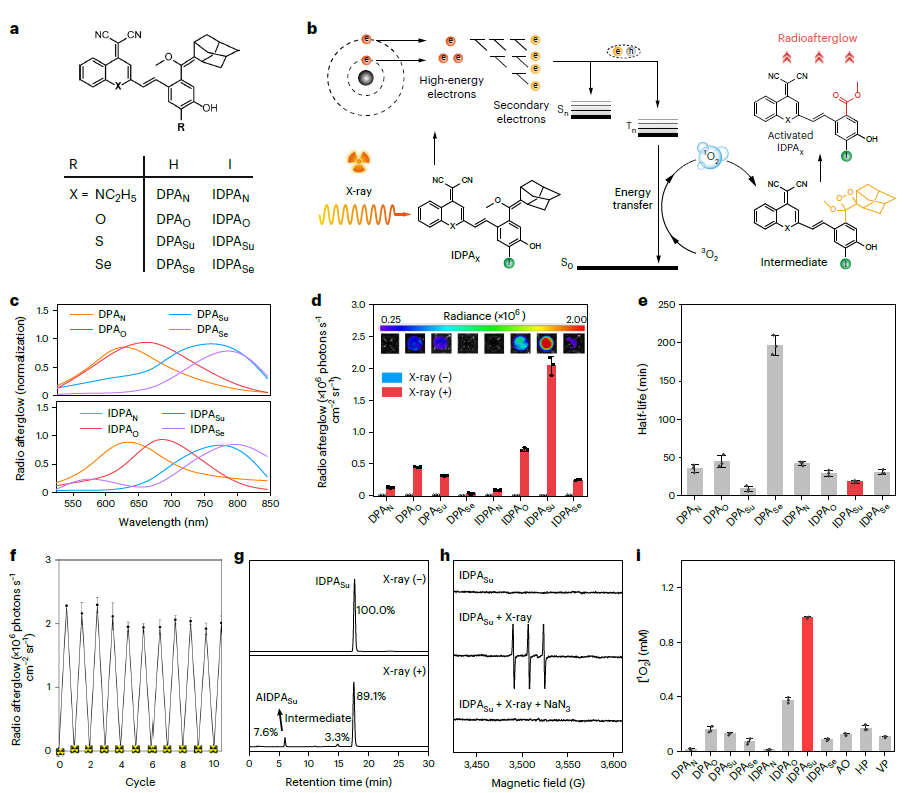
图1:射电余辉动态发光团的合成和表征
IDPAs的辐射余辉机制是基于化学缺陷的辐射动力学形成的新机制,这与无机纳米荧光粉有本质的区别。具体机制:X射线光子首先通过光电效应和康普顿散射与IDPAs中的原子相互作用,激发出高能电子(电离)。这些热电子进一步与周围的原子相互作用,引发能量降低的二次电子级联,形成电子-空穴对(热化)。由于碘和硫的存在,大量的电子以三重态激子的形式存在。这些激子跃迁回基态,激发三线态氧(3O2)到单线态氧1O2(敏化)。原位生成的1O2与IDPAs通过环加成反应生成二氧杂环丁烷中间体。最后,该中间体在释放光子(余辉)的同时逐渐分解为相应的活化产物(活化的IDPAx)。
(2)更深层次的肿瘤成像和治疗。
IDPAs的辐射余辉动力学过程能在15 cm超高灵敏度的记录组织深度下被诱导。并且,由于其智能的生物标志物触发的放射性余辉,组织成像穿透深度达5 cm,信噪比高达234,比X射线激发的无机纳米粒子发射近红外二区余辉高5.7倍。同时,不仅可以对超小肿瘤(0.64 mm)进行超灵敏的检测,而且可以将放疗的特异性提高到分子水平。
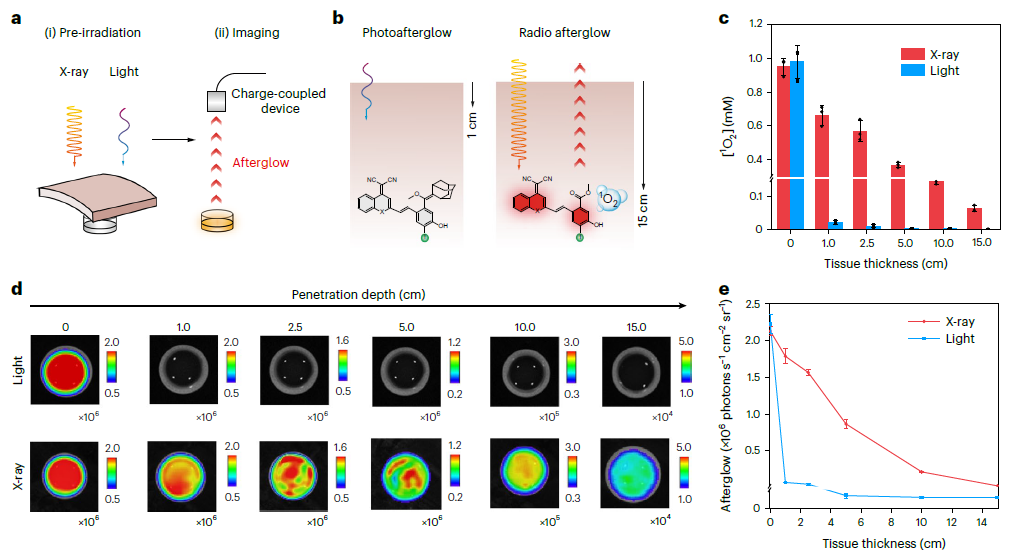
图2:深层组织射电余辉动态过程
(3)最小剂量的精准治疗。
IDPAs在3.2 Gy的辐射剂量下可以抑制脑深部肿瘤的生长,比已报道的放射动力学制剂低6.7倍(> 20 Gy)。
为了实现癌症的精准诊断和治疗,IDPASu被改造成了分子放射余辉动态探针(MRAP),只有在肿瘤标记物(CatB)存在的情况下,它才会激活其放射余辉和放射动力学功能。ESR验证了MRAP的生物标志物可激活辐射动力学效应,结果表明 MRAP与CatB共孵育后再进行X射线照射,1O2的ESR信号增加了7.8。MRAP介导的辐射动力学疗法(Radiodynamictherapy, RDT)组的存活时间从37天延长到76天,在67天前的存活率为100%。
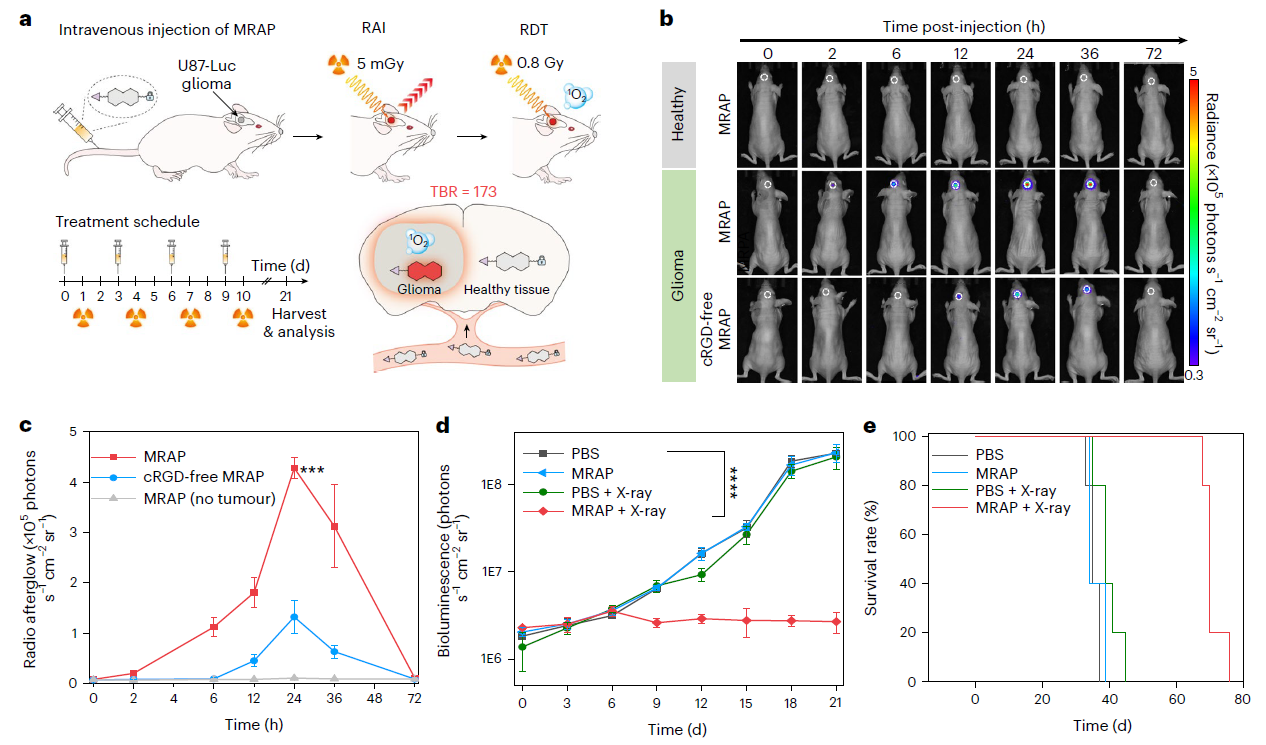
图3:MRAP介导的超小肿瘤检测和精确肿瘤消融MRAP介导的RAI和RDT
3.结论与展望
总之,本文开发出一种有机放射发光体,其性能优于无机纳米磷酸盐,能发出更亮的近红外放射余辉,并能在不使用添加剂的情况下自主产生放射1O2。这些射电发光体的模块化结构有助于精确控制其生理特性,并构建出具有前所未有的生物标记激活射电余辉动态功能的智能分子探针(MRAP)。MRAP的这种生物标志物特异性使其能够以极好的对比度检测微小肿瘤,并以低剂量对深部肿瘤进行分子精确放疗。此外,放射性有机发光体的改性有可能实现图像引导手术和细胞治疗监测。因此,此工作不仅揭示了填补有机放射余辉剂空白的分子指南,而且还强调了精确治疗学的新转化方向。
宋继彬教授个人简介:
宋继彬,北京化工大学,教授、博导、入选国家级高层次青年人才。2014年博士毕业于新加坡南洋理工大学(NTU),化学与生物医药工程专业。2014-2017年在美国国立卫生研究院(NIH)从事博士后研究工作,研究领域为分析化学、化学生物学等。目前主要研究方向为活体成像与分子测量、疾病诊疗新技术等,建立了基于二区比率光学(荧光和光声)成像的活体内分子定量检测新体系。现主持国家自然科学基金联合重点项目、面上项目、省部级重点基金等多项课题。获得省部级医学科学技术进步一等奖1项。学术成果方面,累计发表SCI论文150余篇,主要包括Nat. Mater., PNAS、Angew. Chem.、JACS等,文章被引用13000余次。
