碳氢键的选择性官能化,是当前有机合成化学领域的重要课题。国内外学术界主流的解决方案大都是利用过渡金属催化等方法。化学学院李平凡课题组近年来则致力于发展非主流的硫元素介导的方法,通过不使用过渡金属催化的反应模式,来实现传统意义上较难完成的碳氢键官能化及相关的新反应。
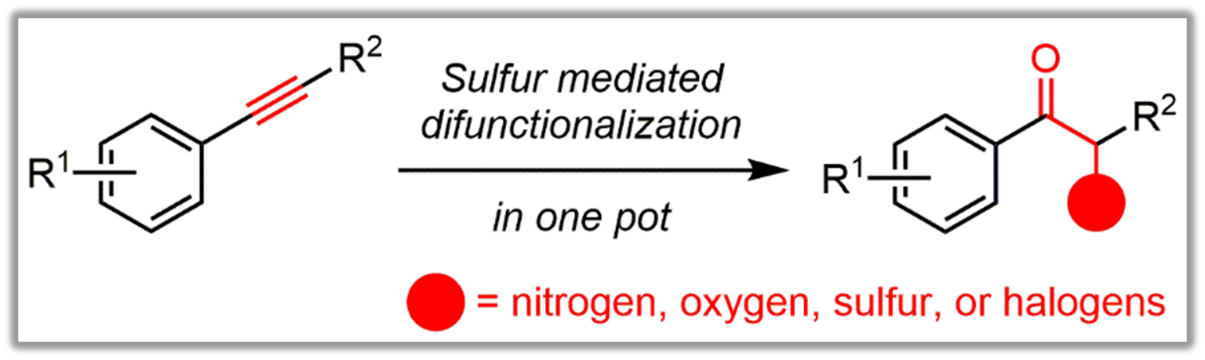
在该课题组前期关于硫元素介导的烯丙位碳氢键烷基化(Org. Lett. 2014, 16, 6036),烯丙位碳氢键胺基化(Chem. Commun. 2016, 52, 11547),炔丙位碳氢键烷基化(Org. Chem. Front. 2018, 5, 2167),芳基取代的内炔烃的亲电环化(J. Org. Chem. 2019, 84, 4517),以及吡啶酮衍生物的合成(Org. Biomol. Chem. 2018, 16, 4151; J. Org. Chem. 2019, 84, 9758)等工作基础上,他们近期发展了一种炔烃双官能化反应(Chem. Sci. 2019, 10, 5156)。如图所示,该反应可实现从苯基取代的内炔烃到多种α-杂原子取代的酮的一锅法高效转化。通过三氟甲磺酸酐活化的亚砜这一超亲电试剂与炔烃反应,生成锍鎓盐取代的烯基三氟甲磺酸酯,再在碱性条件下水解生成α-锍鎓盐取代的酮,继而与一系列氮、氧、硫、卤素等类型的亲核试剂发生取代反应,就可得到相应取代基修饰的α-杂原子取代的酮。在两可亲核试剂的参与下,甚至可以进一步发生分子内缩合,得到结构多样的杂环产物。他们同时也由此发现了一种构建手性中心的新策略:利用硫叶立德的不对称质子化,再经由立体专一性的SN2构型翻转,可实现具有潜在精神类药理活性的手性α-胺基酮的对映选择性合成。这篇文章的第一作者是我院博士毕业生张众(目前在山东大学青岛校区做师资博士后),第二作者是硕士研究生罗宇政,共同通讯作者包括杜洪光教授、许家喜教授和李平凡副教授。
近日,他们进一步发展了针对烯丙位碳氢键的芳基化、环氧化和氮杂环丙烷化反应(J. Org. Chem. 2019, DOI: 10.1021/acs.joc.9b01438),这是该课题组首次在国际著名期刊上免费发表封面文章。如图所示,代表着硫元素的S形河流流向了大海,象征着利用硫元素介导的新反应,将黑色结构式的烯丙位碳氢键原料转化为了红色结构式的芳基化、环氧化或氮杂环丙烷化产物。与前述相关工作类似,该反应的设计思路也是利用三氟甲磺酸酐活化的亚砜的超亲电反应活性,通过它与简单的烯烃底物反应生成烯丙基硫鎓盐中间体,继而在合适的碱性条件下生成烯丙基硫叶立德,并进一步与芳基硼酸、醛或亚胺反应,最终生成烯丙位碳氢键芳基化、环氧化或氮杂环丙烷化的产物。这篇文章的第一作者是我院硕士毕业生罗杭(目前任职于北京保诺科技公司),第二作者是博士毕业生胡罡(目前任教于包头师范学院),通讯作者是李平凡副教授。

该系列工作得到了国家自然科学基金委、教育部中央高校基本科研业务费和科技部化工资源有效利用国家重点实验室的资助。
